I. Introduction
Le monoxyde de carbone, de formule CO, est un gaz incolore et inodore, non irritant, non explosif seul (explosif si avec 12 à 74% d’air), de densité à peine inférieure à celle de l’air (0,967 = diffusion facile dans l’air) et inflammable.
Les intoxications sont particulièrement fréquentes et se manifestent dans des circonstances aussi bien domestiques que professionnelles. Les intoxications sont particulièrement fréquentes ˜10 000/an en France dont 500 décès mortelles.
Nous ne traiterons ici que des étiologies professionnelles.
II. Physiopathologie
Le CO provient de la combustion incomplète des matières carbonées organiques, telles que le charbon, le bois, le papier, l’huile ou l’essence. Sa combustion complète donne du CO2 (dioxyde de carbone ou gaz carbonique ou anhydride carbonique) et de la chaleur.
Il se dégage également lorsqu’une flamme entre en contact avec une surface plus froide que la température de combustion des constituants gazeux de la flamme.
Il connaît une absorption spécifique dans l’infrarouge (ce qui permet sa détection).
2.1. Voie de pénétration dans l’organisme
Essentiellement pulmonaire, l’intoxication est liée à l’apport extérieur de monoxyde de carbone qui est inhalé et traverse très facilement la membrane alévolo-capillaire. Il existe aussi une production physiologique minime de CO par catabolisme des hèmes (myoglobine, hémoglobine et cytochromes).
2.2. Action toxique du CO
Le CO se fixe dans le sang à 80% sur l’hémoglobine pour laquelle il a une affinité 220 fois supérieure à celle de l’oxygène chez l’homme selon la loi d’action de masse :
![]()
Cela signifie que 1 litre de CO se fixe sur autant d’Hb que le ferait 220 l d’O2 ou qu’un taux de 1 l/m3 de CO bloque en théorie 50% de l’Hb, puisqu’il y a 220 l/m3 d’O2 dans l’air. Une faible fraction reste dissoute dans le plasma.
La fixation du CO sur l’hémoglobine se fait suivant une courbe de saturation dont la première phase est rapide et la seconde plus lente (1000 ppm = 1 l de CO pour 1000 l d’air) :
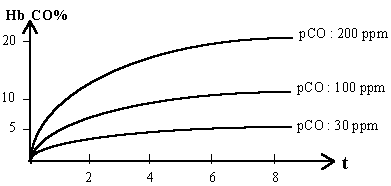
L’action toxique du CO résulte de l’anoxie provoquée par la conversion de HbO2 en HbCO. En effet le CO déplace 1’O2 de sa combinaison avec Hb : HbO2 + CO = HbCO + O2.
La quantité de HbCO va dépendre de:
La concentration initiale de l’HbCO (en particulier pour les fumeurs),
La durée d’exposition,
La concentration atmosphérique de CO et de sa pression partielle (à l’état d’équilibre un sujet respirant dans une atmosphère contenant 1000 ppm de CO à une carboxyhémoglobine à 50%),
L’activité (va augmenter l’absorption et la fixation de CO),
La perfusion et la surface de diffusion pulmonaire,
La tension partielle de 1’O2 dans l’air (la toxicité du CO va augmenter en altitude).
Autres mécanismes qui contribuent à la toxicité du CO :
Effet HALDANE : consiste en une augmentation de l’affinité de Hb pour O2 ce qui va avoir pour conséquence une diminution de la quantité d’O2 disponible au niveau tissulaire.
La fixation de CO sur la myoglobine (environ 20%) (qui va expliquer l’atteinte musculaire) peut réduire le transfert de 1’O2 aux fibres musculaires (le CO à une affinité 2 fois supérieure à l’O2 pour la myoglobine).
La formation de HbCO dans les érythrocytes peut aussi modifier la concentration intracellulaire du 2-3 diphosphoglycérol et va réduire la libération d’O2 dans les tissus.
La fixation (1% restant) sur les oxydases comme le cytochrome P 450 (A3) va contribuer à l’inactiver .
La fixation directe du CO sur certains constituants tissulaires, en particulier le tissus vasculaire, peut expliquer certaines manifestations d’oxycarbonisme chronique (des vasodilatations initiales suivies d’hypoxie entraînent des microhémorragies tissulaires disséminées secondaire à l’ischémie relative des tissus sensibles)
Le CO traverse très aisément la barrière placentaire et pourra se fixer sur l’Hb fœtale et avoir un effet sur la croissance foetale.
L’élimination du CO se fait par voie pulmonaire. Après arrêt de l’exposition, la 1/2 vie est de l’ordre : de 4 à 5h en air ambiant (FiO2 à 21%), de 1h 30 en milieu isobare (FiO2 à 100%) et de 20 minutes en milieu hyperbare (à 3ATA). L’élimination est totale en 12h en air ambiant.
Les conséquences du défaut de transport et d’utilisation périphérique de l’O2 sont d’autant plus marquées que les organes sont plus sensibles à l’hypoxie (la diminution de l’HbO2 déplace la courbe de dissociation de l’oxyhémoglobine vers la gauche).On explique ainsi la vulnérabilité du système nerveux central, du myocarde et du fœtus au cours de l’intoxication oxycarbonée. Celle-ci est également plus sévère lorsqu’elle touche des sujets particulièrement sensibles à l’hypoxie : sujets âgés, sujets anémiés, insuffisants respiratoires et insuffisants coronariens. C’est ainsi qu’un taux de HbCO à 20% (fixation de l’Hb par le CO supérieure au 2/3) engage le pronostic vital chez un sujet coronarien alors que chez le sujet sain il n’entraîne que des manifestations fonctionnelles à type de céphalées:

III. Etiologie
L’intoxication résulte fréquemment de l’utilisation d’un four ou d’un moteur à combustion dans un milieu confiné.
Principales sources d’exposition :
Les mines de charbon, en permanence, mais surtout après un coup de grisou (inflammation du méthane) ou coup de poussier (inflammation du carbone en suspension), tir de mine,
Les ouvriers des puits de pétrole et des gisements de gaz,
La production industrielle de gaz de chauffage,
Industrie sidérurgique: Les gaz produits par les hauts fourneaux contiennent 25 à 30 % de CO,
Fours à ciment et à porcelaine,
Garages, parkings, scieries (moteurs à combustion),
Soudage à l’arc, travaux d’oxycoupage,
Décollage des papiers peints,
Industrie chimique, lors de la synthèse de divers carbonyles, du carbure de calcium, de l’acide formique et acétique et du méthanol,
Accumulation dans des locaux confinés tels que cales de navires, égouts, silos, cuve à vin,
Métabolisation in vitro après inhalation du dichlorométhane (ou chlorure de méthylène) (CH2Cl2) (décapage de peintures), d’hydrocarbures halogénés (trichloroéthylène et tétrachlorure de carbone (CCl4)),
Combustion volontaire avec intoxication de nombreux pompiers.
A noter : le gaz de ville (méthane = gaz de Lacq ne contient pas de CO s’il n’est pas brûlé). A l’état brut son danger est essentiellement lié à la raréfaction de l’oxygène dans l’air qui est remplacé par le gaz.
IV. Diagnostic
4.1. Intoxication aigue
4.1.1. Clinique
Il s’agit presque toujours de circonstances accidentelles. Ces accidents sont souvent graves et mettent fréquemment en cause le pronostic vital.
– Signes de début :
TRIADE CLASSIQUE NON SPÉCIFIQUE :
CÉPHALÉES (résistantes aux antalgiques)
(± bourdonnements d’oreille ou hypoacousie+++)
VERTIGES
ASTHÉNIE VOMISSEMENTS
(souvent trompeuse)
et vomissements (ou nausées, sans diarrhée ni déshydratation). Ces troubles ont souvent un caractère collectif +++.
Signes neuro-musculaires : par la suite, on retrouve des troubles de conscience (œdème cérébral) (obnubilation, agitation +++, convulsion voir coma d’emblée) pas toujours proportionnels au dosage sanguin de CO puis une impotence musculaire (MbCO).
Evolution vers le coma : il s’agit d’un coma souvent profond, calme, hypertonique, rarement convulsif. On retrouve des signes d’irritation pyramidale à l’examen clinique (Babinski bilatéral), des réflexes ostéo-tendineux polycinétiques. A noter des troubles végétatifs avec sudation importante, hyperthermie et hyperpnée.
Signes cutanés : assez caractéristiques avec une couleur rose vif de la peau (couleur cochenille; assez rare en fait), et des phlyctènes au point de pression avec myolyse (rhabdomyolyse possible). Le plus souvent, on note un érythème généralisé (placards érythémateux) avec cyanose.
Signes respiratoires : l’examen clinique met en évidence une hypersécrétion bronchique, avec encombrement secondaire à la toxicité directe du CO (anoxie, hypersécrétion puis polypnée par atteinte cérébrale et vomissements). On peut retrouver un OAP lésionnel ou un syndrome de Mendelsohn (inhalations post vomissements).
Signes cardio-vasculaires : troubles de la repolarisation (VG+++) avec un aspect pouvant évoquer les troubles ischémique, ainsi que des troubles du rythme jusqu’à l’infarctus. On note une labilité tensionnelle avec collapsus (OAP cardiogénique) et risque d’insuffisance rénale fonctionnelle.
Autres signes : rhabdomyolyse, pancréatite ou hépatite aiguë d’apparition parfois un peu retardée.
4.1.2. Biologie
Oxycarbonémie (dosage sanguin du CO) : peut se faire par spectrophotométrie dans l’infrarouge, par colorimétrie après oxydation du CO (après chlorure de palladium) ou par chromatographie en phase gazeuse du CO lui-même ou du méthane.
Sujet normal : 0,15 mmol/l, 0,2 ml/100ml de sang (le taux normal de CO dans l’organisme ne dépasse pas 0,35 mmol/l (ou 0;20 ml/l00ml ; sachant que 1mmol/l = 1ml/100ml ÷ 2,24 = 1/24 ml/l00ml = 0,041 ml/100ml).
Fumeur (et professionnel exposé) : 1,5-3 ml/l00ml
Intoxication aiguë : 6-10 ml/100ml (létal possible à partir de 13 ml/100ml, létal à 17 ml/100ml)
UN TAUX NORMAL N’EXCLUT PAS UNE INTOXICATION AU CO +++
Ce taux peut être variable et va dépendre du temps écoulé après retrait de l’atmosphère toxique et du traitement en cours de transport.
Carboxyhémoglobinémie : dosage par spectrophotométrie directe (absorption dans le visible) ou par calcul après extraction de l’oxyde de carbone dosé directement après dénaturation de l’HbCO secondaire à l’hémolyse provoquée (rarement utilisée). Il est possible de convertir le volume du CO sanguin en % d’HbCO par l’application de la formule suivante :
![]()
L’interprétation des résultats devra tenir compte : du tabac, de l’exposition professionnelle (dichlorométhane et élévation endogène de CO par transformation hépatique) et des troubles médicaux (insuffisants respiratoires, hémolyse…)
Autres signes biologiques :
– Acidose métabolique (en fait mixte) : augmentation des lactates,
– Hyperkaliémie,
– Hyperglycémie (parfois hypoglycémie),
– Hyperleucocytose (PNN par démargination), polyglobulie,
– Élévation des enzymes sériques (CPK, LDH, transaminases, aldolase, amylase)
– Myoglobinémie (souvent avec signe d’insuffisance rénale fonctionnelle),
– Gaz du sang (le plus souvent normaux, il faut apprécier l’hypoxémie par la PaO2).
Autres examens complémentaires : ECG (signes d’anoxie voire de nécrose, troubles du rythme), EEG (peu spécifique avec des bouffées ondes lentes : pronostic +++), radiographie standard pulmonaire et ± scanner cérébral si signes de gravités.
4.1.3. Evolution
– Guérison : le plus souvent rapide en quelques heures
– Décès : 10% des autopsies, 15 à 20 % des cas ayant reçu un traitement. Variables selon l’existence ou non de facteurs de gravité : concentration de CO dans l’atmosphère, durée de l’exposition, délai entre la découverte et le traitement, l’âge, grossesse, tares associées.
– Complications secondaires : REVOIR LES PATIENTS APRÈS 15J À 3 SEMAINES ++++
Syndrome postintervallaire : survient après une guérison totale, de façon retardée, après une quinzaine de jours. Il peut comprendre :
– Un déficit cardiaque : angor, IDM surtout chez les sujets âgés. Pratiquer un ECG.
– Un déficit neurologique : détérioration psychique ou même démence (et troubles neurovégétatifs : sueurs, hyperthermie) avec évolution vers le coma et parfois la mort.
Une TDM cérébrale va retrouver des lésions des noyaux gris centraux avec des microhémorragies et une démyélinisation.
L’anatomopathologie retrouve des lésions vasculaires avec microhémorragies tissulaires disséminées, ainsi que des foyers de nécrose et des zones de démyélinisation liées à l’association d’hypoxie et d’ischémie.
Ce syndrome peut totalement régresser.
Séquelles:
– Neuropsychiques : Immédiates ou après syndrome postintervallaire. Elles font souvent suite à un coma prolongé survenant chez un sujet âgé. Elles peuvent se manifester par des troubles de la mémoire et une détérioration intellectuelle. On peut également rencontrer des paralysies périphériques ou des hémiplégies. Un syndrome de Parkinson séquellaire est également possible, ainsi qu’une cécité corticale ou une hypoacousie. D’autres traductions cliniques peuvent se rencontrer convulsion (EEG à discuter), chorée…
– Musculo-tendineuses: Sous la forme de rétraction douloureuses ou d’ostéomes para-articulaires. Lésions anoxiques myocardiques.
– Infectieuses : thrombophlébites
4.1.4. Diagnostic des formes cliniques particulières
Certaines intoxications oxycarbonées se manifestent de façon inhabituelle soit en raison de leur symptomatologie, soit en raison du terrain sur lequel elles surviennent.
– Les formes neuropsychiques de début peuvent associer des manifestations de type ébrieux avec difficultés d’idéation, actes inappropriés et perturbation de la vision.
– Les formes de l’enfant peuvent être inaugurées par des convulsions.
– Chez le vieillard, la survenue d’un état confusionnel ou d’un déficit neurologique localisé peut faire errer le diagnostic.
– La forme particulière de la femme enceinte permet de souligner qu’il n’y a aucun parallélisme clinique entre la sévérité de l’intoxication maternelle et celle de l’enfant. En début de grossesse, L’anoxie fœtale peut se traduire par une mort fœtale (avortement spontané) ou des risques de malformations congénitales chez l’enfant (tératogénicité de l’anoxie). En fin de grossesse l’intoxication fœtale peut entraîner la naissance d’enfant mort-né ou la naissance d’enfant vivant encéphalopathe (nécrose corticale et des noyaux gris centraux). Il faut noter cependant la possibilité de grossesse normale lors d’intoxication de moyenne ou faible gravité.
– Une forme étiologique particulière mérite d’être mentionnée; c’est celle qui survient après inhalation de chlorure de méthylène ou dichlorométhane. Ce solvant se métabolise en effet partiellement dans l’organisme en oxyde de carbone. Il est utilisé dans les produits décapants pour peintures ou en milieu industriel, et doit être inhalé en atmosphère confinée ou en concentration importante pour être responsable d’une intoxication oxycarbonée grave.
4.1.5. Diagnostic différentiel
Le risque est surtout de méconnaître la possibilité d’une intoxication oxycarbonée mineure qui prélude souvent à une intoxication grave. Il ne faut pas incriminer à tort une toxi-infection alimentaire souvent évoquée par les victimes se plaignant de vomissements et de céphalées. Chez le sujet âgé, il faut également se méfier d’un diagnostic abusif d’accident vasculaire cérébral
4.2. Intoxication chronique
Les sources d’intoxication peuvent être domestiques (chauffe-eau et bains, chauffages (gaz, fuel, charbon), cheminées, braseros, barbecues, poêle à bois ou charbon, garages…. Elles sont souvent professionnelles et surviennent alors lors de l’inhalation de gaz de combustion de moteur (banc d’essais, garages ou parkings mal ventilés…) ou lors d’inhalation de chlorure de méthylène. Un tabagisme important, de l’ordre de 40 cigarettes par jour, peut être source d’intoxication chronique à l’oxyde de carbone.
Clinique – Il s’agit essentiellement de troubles subjectifs tels que céphalées tenaces rebelles aux antalgiques à prédominance vespérales, vertiges (ou le plus souvent une simple instabilité), nausées, vomissements ou une anorexie.
– Troubles psychiques : irritabilité, obnubilation, troubles de la mémoire. On retrouve une perturbation des tests psychophysiologiques ou psychotechniques, avec diminution de la discrimination des signaux colorés, et perturbation des tests de dextérité manuelle et de vigilance. De petites doses de CO peuvent agir sur les fonctions supérieures et de façon variable selon les individus. On a fréquemment un phénomène d’accoutumance.
– Dyspnée d’effort.
– Troubles cardiaques : L’intoxication chronique favorise le développement d’une ischémie chez un coronarien et favorise l’expression d’une symptomatologie angineuse. En raison d’une action toxique du CO sur le tissu de conduction ou le noeud sinoauriculaire, on observe des troubles du rythme. On retrouve également une inadaptation à l’effort.
– Rôle athérogène : suspecté par des études épidémiologiques et par des études expérimentales.
– Toxicité hématologique : Inconstante et contestée. On peut retrouver des anémies ou des polyglobulies.
– Action sur la grossesse: Il existe une action sur la croissance foetale, avec diminution du poids du nouveau né et augmentation de la mortalité néonatale. Une exposition modérée pendant la gestation pourrait entraîner des troubles du comportement et des troubles neurologiques centraux.
Le diagnostic une fois posé repose alors sur :
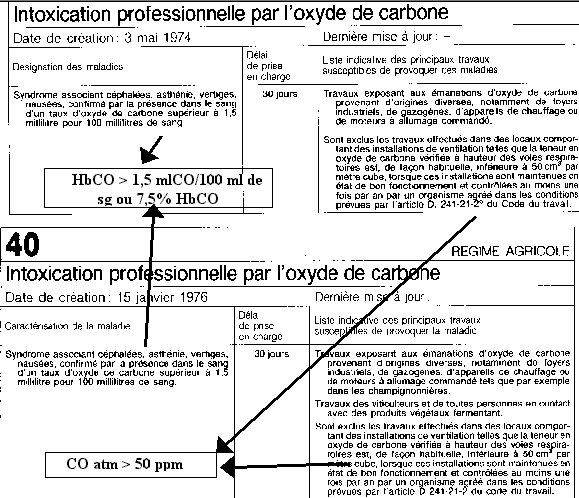
– l’existence d’une source possible de pollution oxycarbonée : source domestique ou professionnelle. La législation fixe dans ce dernier cas une concentration atmosphérique en oxyde de carbone supérieure à 50 ppm (50 cm3/m3 ou 55 mg/m3) pour que la symptomatologie puisse être rattachée à l’origine toxique;
– le dosage de l’oxyde de carbone dans le sang considéré comme anormal pour un taux supérieur à 1,5 ml pour 100 ml.
– on peut aussi doser le CO dans l’air expiré en fin d’expiration (Normale < 2 ppm) (L’ACGIH fixe l’HbCO sanguin à < 3,5% et 20 ppm en fin de poste ; le BAT à < 5%)
Le dosage du CO se fait après 24 h d’abstinence de tabac associé à un dosage de nicotine dans les urines (taux urinaires de thiocyanates +++) et idéalement après 3 jours de travail et en fin de poste.
V. Principes de traitement
5.1. Sur les lieux du travail
Il repose essentiellement sur la suppression de la source d’oxyde de carbone : éviction du poste de travail; suppression du tabagisme; modification d’installations domestiques défectueuses.
En cas d’intoxication aiguë :
– Soustraction de la victime à l’atmosphère toxique
– Le sauveteur doit se protéger avant d’intervenir et prévenir les risques d’explosion (ne pas allumer d’appareil électrique). Le problème est qu’il s’agit d’un gaz non adsorbable sur les charbons actifs et passe les cartouches des masques à gaz ordinaires : les cartouches à base d' » Hopcalite » seraient plus efficaces.
– Oxygénothérapie au masque le plus rapidement possible, en oxygène pur, à grand débit (10l/min). PLS et prélever si possible avant oxygène 10 ml de sang sur anticoagulant (tube hépariné). – Maintien des fonctions vitales (surveillance TA) avant transport médicalisé ± ventilation assistée ± KT veineux.
5.2. En milieu hospitalier
– Si encombrement bronchique : intubation, aspirations répétées,
– Oxygénothérapie isobare : tous les patients et entre les séances de caisson ou si O2 hyperbare impossible. 10l/min pendant 6h chez l’adulte, 3h chez l’enfant ; puis diminuer : 50% à 6h ; 30% de 12-24h. –
Oxygénothérapie hyperbare : si troubles de conscience, grossesse. Attention aux risque de collapsus et d’OAP à la décompression. 1h à 3ATA , avec 15 min pour la compression et la décompression.
– Traitements symptomatique des défaillances viscérales (réa), des comas et complications : (ne pas oublier les antibiotiques +++) voire chir si lésions de nécrose.
– Prévention des récidives : enquête technique sur l’installation responsable de l’intoxication en milieu professionnel ou au domicile (bureaux municipaux d’hygiène ou par les services d’hygiène des préfectures (DDASS et à Paris : laboratoire de Préfecture de Police).
VI. Prévention
6.1. Prévention collective
La VME est de 50 ppm ou 55 mg/m3 à la pression atmosphérique normale. Le NIOSH a recommandé 35 ppm pour un travail de 8 h.
– La prévention peut consister a diminuer l’émission de CO en utilisant un moteur électrique, ou en veillant À la combustion complète du carbone. – De même, il est indispensable de faire des contrôles réguliers d’atmosphère (détecteur de CO mural À LA HAUTEUR DES VOIES AÉRIENNES SUPÉRIEURES) et une détection continue avec un système d’alarme (à 50 ppm) (seul moyen efficace de prévention du risque).

– La pièce doit avoir une ventilation adéquate qui doit être maintenue en bon état de fonctionnement (pour cela un contrôle mensuel est recommandé)
– Un contrôle annuel doit être effectué par un organisme agrée avec mesure de la teneur en CO pendant la durée de travail.
6.2. Prévention individuelle
– Il doit être tenu à la disposition des ouvriers des appareils respiratoires autonomes auxquels ils peuvent recourir en cas d’urgence.
– Il est indispensable d’informer et de former le personnel au risque et de prévoir des exercices d’évacuation.
6.3. Prévention médicale
– Les sujets affectés aux travaux exposant aux émanations de CO dans les usines à gaz, près des conduites de gazogènes ou affectés à la fabrication de l’essence ou du méthanol sont soumis à une surveillance médicale spéciale ( arrêté du 11 juillet 1977 ) .
– Lors de la visite d’embauche, il semble justifié de ne pas exposer les sujets les plus sensibles (coronariens).
– On propose une détermination périodique du taux de CO pendant l’exposition. Un taux supérieur à 1 ml/100ml chez un non fumeur doit amener à faire des contrôles plus fréquents (tous les 6 mois par exemple) et à mener une étude des conditions de travail avec mesure de CO dans l’atmosphère.
VII. Réparation
L’oxycarbonisme chronique comporte une réparation légale par le biais du tableau correspondant de maladie professionnelle (tableau 64 TRG et 40 TRA). Le délai de prise en charge est de 30 jours.
Ce tableau comporte une liste indicative des principaux travaux avec les conditions d’exclusion ( aux de CO inférieur à 50 ppm).
La réparation nécessite un tableau clinique associé à un taux de CO à 1,5 ml/100ml. Il faut également que ces travaux soient effectués dans des locaux ou le taux de CO est supérieur à 50 ppm. L’intoxication aiguë au CO peut être prise en charge dans le cadre des accident de travail (attention à bien le faire préciser sur le CMI).
VIII. Conclusion
L’intoxication au CO est souvent d’origine professionnelle. Elle peut être grave et est souvent méconnue, en raison du caractères subjectif des premiers troubles. La prévention repose sur une mise en oeuvre des mesures collectives et sur une surveillance individuelle.





